Artículo médico
Herramientas de diagnóstico de la pancreatitis canina y felina
El diagnóstico de la pancreatitis en perros y gatos puede ser todo un reto debido a los signos clínicos no específicos y, a veces, sutiles, que se asocian con esta enfermedad.
Natalia Parra
IDEXX Medical Consultant Servicies
María Soto
IDEXX Medical Consultant Servicies

1. FISIOPATOGENIA
El término pancreatitis refiere estrictamente a la inflamación del páncreas exocrino, aunque también se utiliza para otras enfermedades del mismo, caracterizadas por necrosis o cambios estructurales irreversibles como la fibrosis. Según el tipo de infiltrado se clasifican como pancreatitis aguda (PA) o crónica (PC), aunque tradicionalmente también se emplean estos términos para hacer referencia a la forma de presentación clínica.
Normalmente se desconoce su etiología, pero se describen los siguientes factores de riesgo en perros: dieta, hipertrigliceridemia, fármacos y toxinas (bromuro potásico, fenobarbital, azatioprina,…), endocrinopatías (Cushing, hipotiroidismo y diabetes mellitus), predisposición racial (Schnauzer Miniatura, Yorkshire Terrier,…), autoinmune y miscelánea (obesidad, enfermedades infecciosas, hepatitis, hipercalcemia,…).
En gatos, no se han establecido asociaciones con la condición corporal, raza, indiscreción alimentaria o fármacos. Hay casos asociados a traumatismos, al fentión administrado tópicamente y enfermedades infecciosas. La respuesta a terapia inmunosupresora en algunos pacientes con PC sugiere etiología inmunomediada. Se ha asociado a las siguientes enfermedades concurrentes, aunque no se ha podido establecer si son causantes o factores de riesgo: diabetes mellitus, enteropatía crónica, lipidosis hepática, colantigis, nefritis y anemia hemolítica inmunomediada.
Los factores de riesgo descritos producen daño en las células acinares, lo cual libera mediadores inflamatorios que pueden amplificar la respuesta necrótica e inflamatoria en el páncreas y a su vez desencadenar una repuesta inflamatoria sistémica.
La teoría del umbral crítico sugiere que se necesita superar un umbral de daño celular acinar para que se desarrolle el cuadro clínico, y un segundo umbral para que este sea grave. Esto es importante cuando se interpreten resultados alterados en pacientes sin signos clínicos. Hay que tener en cuenta que probablemente estos umbrales no son verdaderos, sino teóricos, variando entre pacientes.
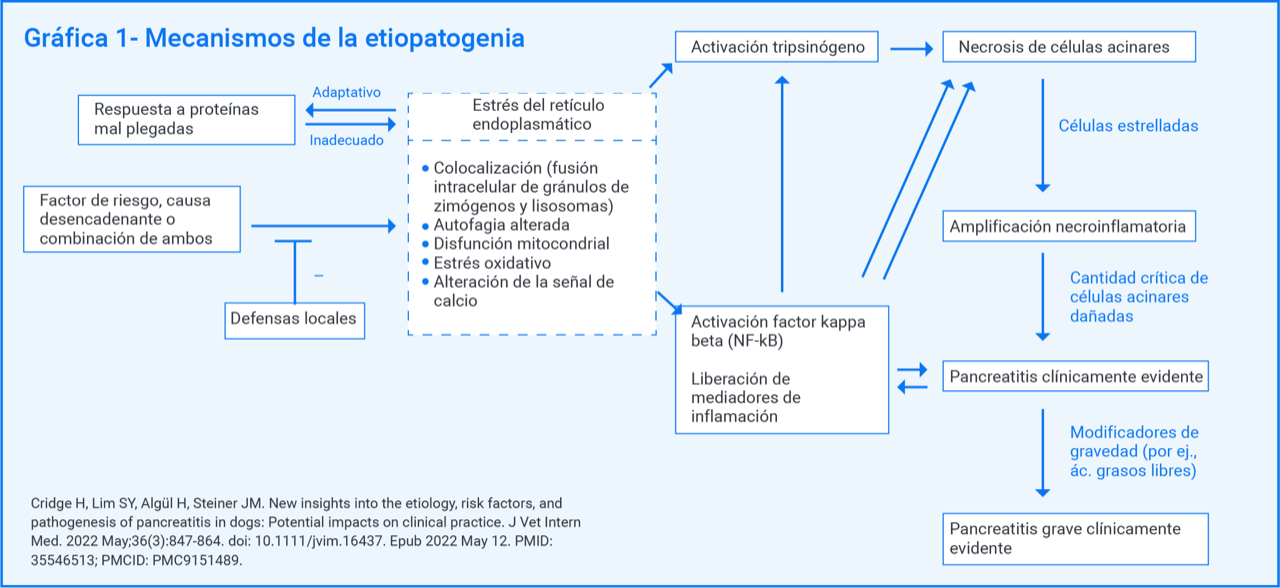
Por tanto, el desarrollo de la pancreatitis y la severidad del cuadro clínico, dependerá de factores genéticos y ambientales, además del equilibrio entre los mecanismos estresantes y los protectores (inhibidores de la tripsina) del individuo. En la gráfica 1 se describen los mecanismos de la etiopatogenia.
Se necesita superar un umbral de daño celular aciniar para que se desarrolle el cuadro clínico.
2. SIGNOS CLÍNICOS
Los pacientes con pancreatitis pueden mostrar un amplio abanico de signos clínicos, algunos son incluso asintomáticos. También se pueden observar signos clínicos derivados de patologías concurrentes o complicaciones.
La tabla 1 muestra los principales signos clínicos y complicaciones.
Tabla 1- Signos clínicos y complicaciones
PA canina
- Anorexia
- Debilidad
- Vómitos
- Diarrea
- Dolor abdominal
- Deshidratación
- Ictericia
- Fiebre o hipotermia
- Diátesis hemorrágica
- Ascitis
- Shock cardiovascular
- Coagulación intravascular diseminada (CID)
- Fallo multiorgánico
PA felina
- Anorexia/hiporexia y letargia son los más frecuentes
- Vómitos
- Diarrea
- Pérdida de peso
- Disnea
- Deshidratación
- Hipotermia o fiebre
- Ictericia
- Taquicardia
- Dolor abdominal
- Palpación de masa abdominal craneal
- Lipidosis hepática, colestasis
- Daño renal agudo
- Neumonía, derrame pleural, edema pulmonar
- Shock
- Miocarditis
- CID
- Fallo multiorgánico
PC (ambas especies)
- Pérdida de peso
- Signos similares, pero más leves e intermitentes
- Presentación subclínica
3. DIAGNÓSTICO
Serán la anamnesis, las alteraciones clínico-patológicas y las pruebas diagnósticas las que nos permitan llegar al diagnóstico de pancreatitis.
Pruebas laboratoriales:
Las pruebas laboratoriales habituales pueden ser normales o presentar cambios no específicos, pero deberán realizarse para excluir otras causas y valorar el estado general (hematología, bioquímica, urianálisis). Podemos encontrar:
- Eritrocitosis o anemia
- Leucocitosis o leucopenia
- Trombocitosis o trombocitopenia
- Aumento de enzimas hepáticas, hiperbilirrubinemia, alteraciones electrolíticas, azotemia. Ocasionalmente pueden detectarse cambios en albúmina, triglicéridos y colesterol.
- Coagulopatía (CID, aumento de los tiempos de coagulación y/o dímero D).
Diagnóstico por imagen:
Las radiografías no aportan valor diagnóstico dado que los cambios observables no son específicos, pero pueden descartar otras condiciones clínicas.
La ecografía es el método más empleado e indicado, pero depende en gran medida de la experiencia del operador y la calidad del equipo, por lo que su sensibilidad y especificidad pueden variar. En casos de cuadros muy agudos o crónicos o leves los cambios pueden ser imperceptibles.
En la bibliografía se describe una sensibilidad variable: Hess, en 1998, del 68% comparando con histopatología, en perros; Williams, en 2013, del 84% analizando la concordancia con la fPLI, en gatos. En ese estudio Williams menciona referencias previas descritas de 11-67%. Oppliger, en 2014, reporta un grado de concordancia leve entre la ecografía y la Spec fPL® y DGGR. Kook, en 2014, detecta una muy buena correlación entre lipasa DGGR y PLI en perros, pero una concordancia con la ecografía más limitada. Cridge, en 2021, describe cómo la ecografía pasa de una sensibilidad del 89% pero con una especificidad del 43% si hay un hallazgo únicamente propio de PA, mientras que estos valores se invertían si había 3 hallazgos ecográficos.
Existen distintos análisis específicos del páncreas, cuya capacidad para el diagnóstico certero de pancreatitis ha sido ampliamente estudiada.
Puede haber falsos positivos: lesiones en parénquima fruto de episodios anteriores y cambios debidos a la edad o la raza.
Pruebas laboratoriales específicas:
Existen distintos análisis específicos del páncreas, cuya capacidad para el diagnóstico certero de pancreatitis ha sido ampliamente estudiada.
Lipasa 1,2-diglicérido:
- Es la lipasa general, se mide su actividad catalítica, pero tiene una utilidad diagnóstica limitada debido a la influencia de fuentes no pancreáticas.
Lipasa 1,2-o-Dialuryl-rac-glycero-3-glutaric Acid-(6´-methylresorufin) Ester DGGR:
- Es un método catalítico, pero con mayor especificidad analítica que la general (esto es, una mayor habilidad de medir únicamente la sustancia de interés). Su especificidad para el diagnóstico de pancreatitis depende de los criterios empleados, el tipo y grado de pancreatitis y el punto de corte elegido. Numerosos estudios han descrito su sensibilidad y especificidad, comparándola con métodos como lipasas específicas, ecografía o histopatología. En la mayor parte de ellos se mostraba una buena correlación con Spec cPL® (Hook 2014), Spec fPL® (Oppliger 2013), cPL (Wolfer 2022) y fPL (Krastzel 2021). En 2015 Steiner abrió el debate sobre su especificidad analítica al detectarla en perros con insuficiencia pancreática exocrina (IPE) (Yee Lim 2022).
- Recientemente IDEXX Laboratorios ofrece la Catalyst® Lipasa Pancreática, una lipasa DGGR con una demostrada especificidad analítica, ya que no se ha detectado en perros con IPE. Muestra una correlación excelente con Spec cPL® y Spec fPL®, proporcionando a los veterinarios una prueba precisa y cuantitativa de lipasa pancreática en la clínica para el diagnóstico de la pancreatitis.
Spec cPL® y Spec fPL®:
- Spec cPL® y Spec fPL® cuantifica la lipasa pancreática específica canina y felina, respectivamente, mediante un ELISA que emplea anticuerpos monoclonales. Varios estudios han descrito la cPL como un ensayo preciso, lineal, estable y reproducible. Muestra una sensibilidad de 70-100%, siendo menor en pancreatitis leves (Wolfer 2022), y una especificidad de 90-97,4% (Cridge 2021) y 59-78% (Yee Lim 2022). Cridge también hallaba diferencias en sensibilidad según la presentación y afectación histopatológica, pues en la PC puede haber menor liberación enzimática en tejidos fibróticos y/o atrofiados.
- Forman en 2009 describe una sensibilidad para Spec fPL® del 79% y una especificidad del 82%. Oppliger en 2013 los obtiene más bajos: 57% y 63%, respectivamente.
- Existen otras cPL y fPL; en alguna no está claro si emplean anticuerpos monoclonales o policlonales, pudiendo esto afectar a su especificidad (Yee Lim 2022).
Tests rápidos:
- Son inmunoensayos semicuantitativos que miden la lipasa pancreática específica. Para el SNAP® cPL la bibliografía describe muy buena sensibilidad (70-94%) y especificidad (59-88%). Para el SNAP® fPL la sensibilidad oscila entre 54% en casos leves y 100% en casos moderados o graves y la especificidad entre 67% en gatos sintomáticos y 100% en asintomáticos.
Se describen aumentos de cPL en otras enfermedades, como Cushing, diabetes mellitus o enfermedad renal, aunque pueden ser causa o consecuencia de una pancreatitis. Un estudio rebatió el aumento de cPL en enfermedad renal dado que no encontró relación con una tasa de filtración glomerular reducida. (Yee Lim 2022)
Histopatología:
Se ha considerado tradicionalmente y en múltiples estudios como el método de referencia, pero raramente se realiza ante mortem, debido a su invasividad, coste y riesgos, y la posibilidad bien de omitir zonas lesionadas localizadas o detectar anormalidades que clínicamente pueden ser irrelevantes.
4. TRATAMIENTO
El tratamiento es principalmente de soporte y sintomático. Es importante tratar la posible causa primaria, comorbilidades y complicaciones.
Se recomienda administrar fluidos cristaloides intravenosos para corregir la deshidratación, los desórdenes electrolíticos y normalizar la volemia. Si fuera insuficiente, se pueden administrar coloides o vasopresores, aunque puede haber complicaciones asociadas (daño renal agudo, coagulopatías). El plasma fresco congelado tiene beneficios potenciales pero se debería reservar para casos con CID.
El manejo de las náuseas y vómitos facilita la tolerancia a la alimentación oral, tanto voluntaria como mediante sonda de alimentación. Los antieméticos más utilizados son maropitant y ondansetron. En pacientes con íleo paralítico o retraso en el vaciado gástrico, se recomienda el uso de procinéticos, como cisaprida o metroclopramida en infusión continua.
Se recomienda la alimentación temprana, pudiendo utilizar estimulantes del apetito, como mirtazapina o capromorelina, o sondas de alimentación. En nutrición parenteral las tasas de supervivencia son menores. Se recomiendan dietas altamente digestibles y que en perros el contenido graso sea bajo o moderado.
Es importante identificar y manejar el dolor, especialmente en la especie felina, donde puede subestimarse con mayor facilidad. Habitualmente se administran opiáceos, que se pueden combinar con gapatentina oral en los gatos o infusiones continuas de lidocaína y ketamina (junto a fentanilo) en los perros.
La antibioterapia debería reservarse a los casos con sospecha de infección bacteriana o sepsis.
No se recomienda el tratamiento con AINEs por sus posibles efectos secundarios. Tampoco hay suficiente evidencia para recomendar el uso rutinario de corticosteroides, aunque podrían ser beneficiosos en algunos pacientes. Dado que están indicados para el tratamiento de algunas enfermedades concurrentes, deberían considerarse en estos casos.
5. MONITORIZACIÓN
En la literatura reciente se ha descrito la utilidad de la proteína C reactiva (CRP). Keany en 2021 demostró una buena correlación entre el índice de actividad canina modificado (MCAI) y CRP. Aunque la cPLI guardó una mejor relación con dicho índice día a día, se concluyó que la CRP es un biomarcador útil para la monitorización en casos de pancreatitis aguda en perros.
Se recomienda monitorizar las alteraciones clínico-patológicas presentes en cada paciente, especialmente la cPL/fPL, la lipasa DGGR o la Catalyst® Lipasa Pancreática si estaban aumentadas en el momento del diagnóstico.
- Cridge, Harry et al. “Association between abdominal ultrasound findings, the specific canine pancreatic lipase assay, clinical severity indices, and clinical diagnosis in dogs with pancreatitis.” Journal of veterinary internal medicine vol. 34,2 (2020): 636-643. doi:10.1111/jvim.15693
- Cridge, Harry et al. “Advances in the diagnosis of acute pancreatitis in dogs.” Journal of veterinary internal medicine vol. 35,6 (2021): 2572-2587. doi:10.1111/jvim.16292
- Cridge, Harry et al. “New insights into the etiology, risk factors, and pathogenesis of pancreatitis in dogs: Potential impacts on clinical practice.” Journal of veterinary internal medicine vol. 36,3 (2022): 847-864. doi:10.1111/jvim.16437
- Forman, Marnin A et al. “Evaluation of feline pancreas-specific lipase (Spec fPLTM) for the diagnosis of feline pancreatitis.” Abstract in: Proceedings of the American College of Veterinary Internal Medicine Forum. American College of Veterinary Internal Medicine; 2009:733–734.
- Forman, Marnin A et al. “ACVIM consensus statement on pancreatitis in cats.” Journal of veterinary internal medicine vol. 35,2 (2021): 703-723. doi:10.1111/jvim.16053
- Hess, R S et al. “Clinical, clinicopathologic, radiographic, and ultrasonographic abnormalities in dogs with fatal acute pancreatitis: 70 cases (1986-1995).” Journal of the American Veterinary Medical Association vol. 213,5 (1998): 665-70.
- Keany, Kirstin M et al. “Serum concentrations of canine pancreatic lipase immunoreactivity and C-reactive protein for monitoring disease progression in dogs with acute pancreatitis.” Journal of veterinary internal medicine vol. 35,5 (2021): 2187-2195. doi:10.1111/jvim.16218
- Kook, P H et al. “Agreement of serum Spec cPL with the 1,2-o-dilauryl-rac-glycero glutaric acid-(6'-methylresorufin) ester (DGGR) lipase assay and with pancreatic ultrasonography in dogs with suspected pancreatitis.” Journal of veterinary internal medicine vol. 28,3 (2014): 863-70. doi:10.1111/jvim.12334
- Krasztel, Magdalena Maria et al. “The Agreement between Feline Pancreatic Lipase Immunoreactivity and DGGR-Lipase Assay in Cats-Preliminary Results.” Animals : an open access journal from MDPI vol. 11,11 3172. 6 Nov. 2021, doi:10.3390/ani11113172
- Lim, Sue Yee et al. “Understanding lipase assays in the diagnosis of pancreatitis in veterinary medicine.” Journal of the American Veterinary Medical Association vol. 260,11 1249-1258. 8 Jun. 2022, doi:10.2460/javma.22.03.0144
- Lim, Sue Yee et al. “Management of acute-onset pancreatitis in dogs: a Narrative Review.” Journal of the American Veterinary Medical Association vol. 262,9 1231-1240. 5 Jun. 2024, doi:10.2460/javma.24.02.0107
- Oppliger, S et al. “Agreement of the serum Spec fPL™ and 1,2-o-dilauryl-rac-glycero-3-glutaric acid-(6'-methylresorufin) ester lipase assay for the determination of serum lipase in cats with suspicion of pancreatitis.” Journal of veterinary internal medicine vol. 27,5 (2013): 1077-82. doi:10.1111/jvim.12150
- Oppliger, Samuel et al. “Agreement of serum feline pancreas-specific lipase and colorimetric lipase assays with pancreatic ultrasonographic findings in cats with suspicion of pancreatitis: 161 cases (2008-2012).” Journal of the American Veterinary Medical Association vol. 244,9 (2014): 1060-5. doi:10.2460/javma.244.9.1060
- Puccini Leoni, Federico et al. “Ultrasonographic Monitoring in 38 Dogs with Clinically Suspected Acute Pancreatitis.” Veterinary sciences vol. 7,4 180. 16 Nov. 2020, doi:10.3390/vetsci7040180
- Serrano, Gonçalo et al. “Increased canine pancreatic lipase immunoreactivity (cPLI) and 1,2-o-dilauryl-rac-glycero-3-glutaric acid-(6'-methylresorufin) ester (DGGR) lipase in dogs with evidence of portal hypertension and normal pancreatic histology: a pilot study.” Journal of veterinary diagnostic investigation : official publication of the American Association of Veterinary Laboratory Diagnosticians, Inc vol. 33,3 (2021): 548-553. doi:10.1177/10406387211003987
- Steiner, JM et al. “DGGR is not a specific substrate for pancreatic lipase.” Abstract in: Proceedings of the 40th World Small Animal Veterinary Association Congress. World Small Animal Veterinary Association; 2015:71.
- Thomson, James M, and Tim L Williams. “Retrospective analysis of association between hepatopathy and serum DGGR lipase activity in dogs: a pilot study.” Journal of veterinary diagnostic investigation : official publication of the American Association of Veterinary Laboratory Diagnosticians, Inc vol. 34,5 (2022): 854-858. doi:10.1177/10406387221106401
- Williams, J M et al. “Ultrasonographic findings of the pancreas in cats with elevated serum pancreatic lipase immunoreactivity.” Journal of veterinary internal medicine vol. 27,4 (2013): 913-8. doi:10.1111/jvim.12117
- Wolfer, Lina A et al. “Accuracy of 1,2-o-Dilauryl-rac-glycero-3-glutaric Acid-(6'-methylresorufin) Ester (DGGR)-Lipase to Predict Canine Pancreas-Specific Lipase (cPL) and Diagnostic Accuracy of Both Tests for Canine Acute Pancreatitis.” Veterinary sciences vol. 9,4 177. 8 Apr. 2022, doi:10.3390/vetsci9040177
- Xenoulis, P G. “Diagnosis of pancreatitis in dogs and cats.” The Journal of small animal practice vol. 56,1 (2015): 13-26. doi:10.1111/jsap.12274